Análise de mel
Disciplina de Farmacognosia I, UFPR
O mel natural é um produto açucarado fornecido pela abelha Apis mellifera L., Apidae. O produto é uma solução aquosa concentrada de açúcares, geralmente com predominância de frutose e glucose, e de pequenas quantidades de dextrinas, enzimas, ceras, óleos voláteis, ácidos orgânicos, éteres, substâncias gomosas, albuminoides e minerais. A principal forma de falsificação do mel é pela adição de açúcar comercial, glucose e dextrinas. Além disso, pode ocorrer no comércio mel artificial, que é constituído por açúcar com adição de substâncias aromáticas e/ou de mel natural. A análise do mel tem por finalidade descobrir se o produto é genuíno, artificial ou falsificado.
Aula Prática
1. Tomada de amostra
- A amostra deve ser tomada de diferentes partes do lote antes de se proceder à mistura.
- Misturar bem cerca de 250 g do mel em análise e colocar em frasco fechado.
2. Caracteres externos e organolépticos
- Observar e anotar a cor, sabor, odor e consistência.
O mel pode ser branco (provavelmente centrifugado), pardo (provavelmente de coníferas) ou com coloração intermediária de amarelo claro a amarelo esverdeado. O sabor, se mais ou menos doce, com ligeira sensação acre, é devido à presença de pequenas quantidades de ácidos fórmico e málico. O aroma, se agradável, é característico de mel normal.
3. Exame microscópico
- Colocar 1 gota de mel e 1 gota de solução de glicerina iodada entre lâmina e lamínula;
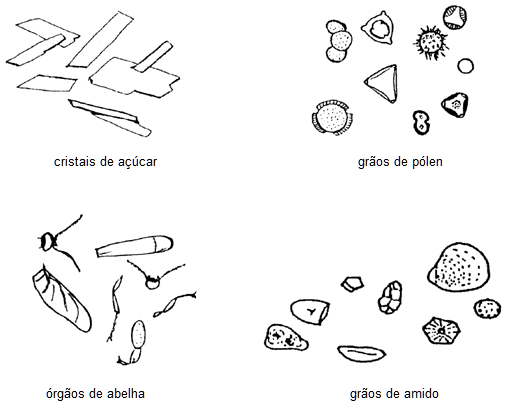
- Reconhecer a presença de grãos de pólen, grãos de amido, resíduo de órgãos de abelha, elementos vegetais, cera e cristais de açúcar.
4. Determinação da densidade
- Dissolver 1 parte de mel em 2 partes de água destilada;
- Transferir para uma proveta de tamanho apropriado;
- Introduzir o densímetro e anotar a densidade, que deve ser igual ou superior a 1,099 a 25 ºC.
5. Determinação da acidez
- Pesar exatamente a tomada de amostra (10 g) de mel e dissolver em 50 ml de água destilada;
- Juntar 2 gotas de solução de fenolftaleína Sl e titular com solução de NaOH 0,1 N até o aparecimento de leve coloração rósea persistente.
Deve ser consumida quantidade menor ou igual a 5 ml da solução de NaOH. Uma acidez superior a esse volume de álcali indica que o mel está em fase adiantada de fermentação. A acidez pode ser expressa em mililitros de NaOH por 100 g de mel. Pode também ser expressa em relação ao ácido fórmico, onde cada mililitro de NaOH 0,1 N consumido corresponde a 0,0046 g de ácido fórmico (PM do ácido fórmico: 46,02).
6. Reações cromáticas
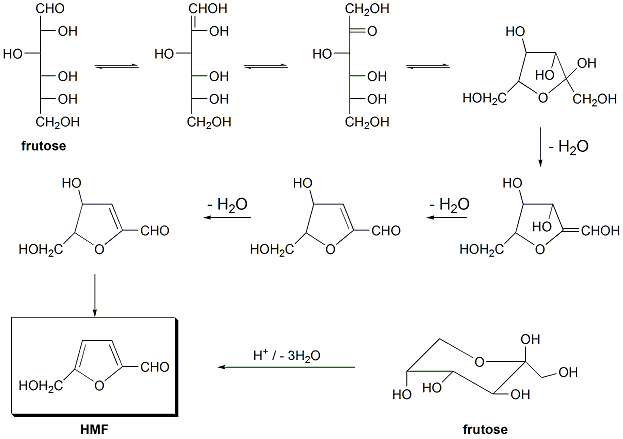
Essas reações têm por finalidade identificar a presença de hidroximetilfurfuraldeido (HMF) encontrado no mel. O HMF é usado como um indicador de aquecimento e modificações decorrentes de armazenamento incorreto do mel. É formado pela quebra da frutose em presença de ácido e o aquecimento aumenta a velocidade da reação. O HMF ocorre naturalmente no mel (normalmente na faixa de 1 mg/kg) e não é uma substância tóxica. Apenas indica que, quando detectado em quantidade superior a 80 mg/kg demonstra a presença de adulteração por açúcar comercial ou aquecimento indevido. O mel, quando estocado à 20 ºC, aumenta em cerca de 1 mg/kg/mês a quantidade de HMF.
Reação de Jagerschmidt
- Triturar em gral de porcelana cerca de 10 g de mel com 10 ml de acetona;
- Decantar o solvente e transferir cerca de 2-3 ml para um tubo de ensaio contendo igual volume de HCl conc.;
- Esfriar a mistura em um banho de gelo ou água corrente.
O aparecimento de forte coloração violeta indica presença de açúcar comercial. Se o mel é natural, pode surgir uma leve coloração âmbar que se torna violácea depois de algum tempo.
Reação de Fiehe
Verifica a presença de açúcar comercial ou o aquecimento acima de 40% do produto, o que pode eliminar algumas de suas propriedades.
- Pesar 5-10 gotas de mel em um gral de porcelana;
- Extrair (triturar) com quantidade suficiente de éter etílico e transferir a camada etérea para um cadinho de porcelana;
- Deixar o éter evaporar à temperatura ambiente e, em seguida, adicionar 5 gotas de solução clorídrica de resorcina a 1% (Dissolver 1 g de resorcina em 100 ml de ácido clorídrico concentrado).
- Leitura após 5–10 min.
O aparecimento de coloração vermelha indica a presença de HMF (reação do HMF com a resorcina), possivelmente em quantidade maior que 200 mg/kg. O vermelho cereja indica mel de péssima qualidade e a intensidade do vermelho está relacionada à quantidade de HMF presente no mel.
7. Reação de Lund
Baseia-se na determinação de substâncias albuminoides precipitáveis como o ácido tânico. Determina também se houve adição de água ou outro diluidor no mel.
- Dissolver 2 g de mel em 20 ml de água e transferir para uma proveta graduada de 50 ml;
- Adicionar 5 ml de solução de ácido tânico a 5% e completar o volume com água destilada até a marca de 40 ml;
- Agitar com cuidado e após 24 h ler o volume de precipitado no fundo da proveta.
Se o mel é puro, o precipitado oscila entre 0,6 a 3 ml. Em mel artificial ou diluído, não se produz precipitado ou aparece apenas vestígios. Essa pesquisa não tem valor se o mel foi submetido a temperaturas elevadas.
8. Pesquisa de enzimas diastásicas
- Dissolver 1 g de mel em 20 ml de água destilada previamente fervida e resfriada a 45 ºC;
- Em um tubo de ensaio, previamente lavado com água fervida, adicionar 10 ml da solução de mel (não filtrada) e em seguida 1 ml de solução de amido solúvel a 1% recém preparada e límpida; guardar os 10 ml restantes em outro tubo para prova em branco a ser feita no final do experimento;
- Agitar bem o tubo que contém a mistura com solução de amido e deixar em banho-maria a 45 ºC exatamente 1 h;
- Tomar os dois tubos (branco e ensaio) e adicionar em ambos algumas gotas de solução de lugol e observar a cor que o líquido desenvolve.
Se, após a adição do lugol, a cor do líquido no tubo-ensaio é mais escura que a da solução original do mel, isto é, de amarelo a amarelo esverdeado ou pardo, todo o amido foi sacarificado pela presença, no mel, de enzimas diastásicas; se, porém, o líquido torna-se azul, a sacarificação não foi realizada, pela ausência ou destruição das enzimas diastásicas. Finalmente, se a cor do líquido vai do violeta forte ao violeta pardo, pode indicar uma diminuição do poder diastásico que transforma o amido somente em dextrinas. Isso acontece em mel centrifugado onde ocorrem um certo aquecimento durante o processo e nas misturas de mel natural com mel artificial. Se os resultados são duvidosos, repetir o ensaio.
9. Pesquisa de corantes
- Pesar 1 g de mel e dissolver em 10 ml de água destilada;
- Adicionar cerca de 2 ml de solução de ácido sulfúrico a 5%.
O mel deve permanecer com a coloração inalterada. Se existem substâncias corantes adicionadas ao mel, a cor passa gradualmente de violeta a rosa.
10. Determinação de cinzas
- Pesar exatamente a tomada de amostra (cerca de 10 g) de mel em uma cápsula de porcelana tarada;
- Aquecer cuidadosamente em chama até que cesse o entumescimento;
- Tomar cuidado para evitar projeção de gotículas;
- Incinerar à temperatura de 450 ºC até que se obtenha resíduo branco (cerca de três horas).
Deve-se obter no máximo 0,35% de cinzas.
11. Determinação de açúcares
O mel é constituído por quantidades variáveis de sacarose e açúcares redutores, com predominância de frutose e glucose.
Determinação da rotação óptica
- Tomar 30 ml do filtrado obtido no item 3 e adicionar 1 ml de solução de ácido tânico a 5%;
- Filtrar por papel de filtro;
- Com 20 ml do filtrado, observar a rotação óptica usando polarímetro;
- Calcular o valor obtido.
As soluções de mel devem, de um modo geral, apresentar rotação levógira devido à frutose o que exclui a presença de dextrinas e, indiretamente, a presença de glucose comercial. Se a rotação for debilmente levógira ou dextrógira, é necessário fazer pesquisa de dextrinas uma vez que o mel natural também pode se comportar de modo análogo mesmo sem conter tais substâncias.
Presença de dextrinas
- Dissolver 5 g de mel em 10 ml de água destilada;
- Juntar 0,5 ml de uma solução de ácido tânico a 5%;
- Filtrar por papel de filtro após clarificação do líquido;
- Adicionar a uma porção do filtrado (cerca de 5 ml) 2 gotas de HCl conc para cada mililitro do filtrado tomado e dez vezes e seu volume de EtOH absoluto.
Se o líquido turvar a leitoso (pode-se tolerar um ligeiro turvamento) há um indício de presença de dextrinas e, portanto, glucose comercial. Para confirmar o ensaio, em caso de dúvida, pode-se repetir empregando maior quantidade de mel.
- Pesar 40 g do mel em análise em um erlenmeyer de 250 ml;
- Dissolver a tomada de amostra em 50 ml de água destilada e adicionar em seguida EtOH absoluto até a marca;
- Deixar em repouso por 2-3 dias;
- Recolher o precipitado, executar sobre este as reações específicas para dextrina e determinar o poder rotatório para a identificação.
12. Determinação de água
- Preparar uma cápsula de porcelana, deixando-a em estufa a 110 ºC por 30 min;
- Resfriar em dessecador e tarar,
- Pesar exatamente a tomada de amostra (cerca de 2 g) de mel e secar em estufa a 110 ºC por 5 h;
- Pesar e calcular a porcentagem.
O mel deve conter no máximo 22% de água (oscila entre 8,5–20%). Se a quantidade for acima de 22% deve deduzir-se que a água foi adicionada fraudulentamente ou que se trata de um mel colhido prematuramente.
Apostila de Aula Prática de Farmacognosia UFBA
O mel, segundo os documentos da Antiguidade, era utilizado como remédio nos tempos mais remotos por quase todos os povos, o que se deve as suas ações anti-sépticas e bactericidas.
O mel é um produto elaborado pelas abelhas (Apis mellifera L.) a partir do néctar das flores e exudatos sacarínicos de plantas e que são armazenados por elas em favos.
O mel é um produto rico em vitaminas B1, B2, B5, B6, C, A e K, além de apresentar a seguinte composição química:
| água |
20% |
açúcares |
78% |
proteínas |
0,5% |
lipídios |
0,2% |
minerais |
0,1%* |
* S, P, Cl, Na, K, Ca, Mg, Ni, Pb, Si, Fe, Mn, Cu, I.
Os 78% de açucares que estão na composição do mel podem estar dispostos da seguinte maneira:
Glicose |
35% |
Frutose |
40% |
Dextrose |
2,5% |
Sacarose |
0,1% |
O mel é essencialmente constituído por glicose, frutose e açúcares monossacarídicos muito facilmente assimiláveis; a propriedade dos monossacarídeos de passar para o sangue sem sofrer qualquer transformação intermediária é utilizada no tratamento dum grande número de doenças (injeção direta de glicose).
Ora, é precisamente à custa de substâncias açucaradas que o nosso organismo consegue mais da metade da energia. Deste ponto de vista a importância do mel é incontestável.
Prática
Objetivo: Verificar possíveis adulterações em amostras de mel adquiridas em diferentes pontos de venda.
Material de uso comum
- Refratômetro de Abbé
- Solução Clorídrica de Resorcina
- Éter Etílico
- Pipetas graduadas: 1 mL, 5 mL, 10 mL
- Solução de Lugol
- Solução de Ácido Tânico a 0,5 %
- Papel toalha
Material por grupo
- Tubos de ensaio
- Lâminas e lamínulas
- Cilindro graduado com rolha esmerilhada de 25 mL, 50 mL
- Béquer de 50 mL
- Papel de filtro
- Funil
Coleta da amostra:
Devem obedecer as normas previstas no decreto n.º 989 de 21/10/69 do Governo Federal, assim distribuídos:
Sempre em grupo de três amostras sendo que: uma fica em poder do detentor de maneira inviolável e duas vão para o laboratório. Destas uma é aberta para fazer as análises e a outra fica lacrada.
Preparo da amostra:
Quando o mel se apresentar fluido basta homogeneizá-lo bem, se, porém se apresentar semi cristalizado ou cristalizado deverá ser levado em banho-maria sob constante agitação e que não ultrapasse a temperatura de 60 ºC.
Características organolépticas
(de acordo com o decreto 12342 de 27 de setembro de 1978):
- Aspecto - líquido denso, viscoso, translúcido ou parcialmente cristalizado.
- Cor - levemente amarelada ou castanho-escuro.
- Odor - próprio.
- Sabor - próprio e doce.
Características físico-químicas
(de acordo com o decreto 12342 de 27 de setembro de 1978):
Umidade
- O método recomendado e mais utilizado é por refratometria a 20 ºC com interpretação feita em leitura da tabela de Chataway.
Material - Refratômetro de Abbé e Circulador de água a 20 ºC
Determinação do índice de refração
- Limpe os prismas com etanol e coloque algumas gotas do mel de modo a cobrir o prisma inferior;
- Feche os prismas, ligue a fonte luminosa e olhe no visor;
- Ajuste a lâmpada, movendo-a para cima ou para baixo de modo a permitir o máximo de iluminação dentro do visor. Percebem-se linhas cruzadas;
- Gire o controle de ajuste do índice de refração até que se observe uma linha horizontal dividindo o campo visual em duas partes. Uma clara e outra escura;
- Se a interface das duas cores apresenta-se difusa, como uma banda colorida, ajusta-se a dispersão da cor, girando o botão de ajuste cromático até obtenção de uma linha divisória nítida;
- Gire o controle do ajuste do índice de refração (botão maior) até observar uma linha horizontal nítida exatamente na interseção das linhas cruzadas. Neste ponto, a imagem está ajustada para a leitura correta.
- Efetue a leitura do índice de refração na escala observada pelo visor.
- Depois da leitura, limpe os prismas com etanol e algodão e só os feche após a evaporação do álcool.
Correção da temperatura
Utilize a fórmula para calcular o índice de refração a 20 °C a partir do valor medido na temperatura do laboratório.
nd 20 = nd t
+ 0.00045 (t - 20)
nd 20 = índice de refração a 20 °C
nd t = índice de refração medido a temperatura (t) do laboratório
t = temperatura no momento da medida
Sólidos solúveis
- Todos devem ser determinados pela utilização do Refratômetro de Abbé e com o auxílio da tabela de Chataway.
Índice de refração
- Determinado pelo Refratômetro de Abbé e tabela de Chataway.
Reação de Fiehe
- Transferir 5 mL da amostra para um cilindro graduado de 50 mL com rolha esmerilhada. Adicione 5 mL de água destilada e misture bem.
- Adicione 5 mL de éter etílico, agite e deixe em repouso até a separação em camadas (a camada etérea deve estar clara).
- Transfira 2 mL da solução etérea para um tubo de ensaio, adicione 2 gotas de solução de resorcina recentemente preparada e agite. Na presença de açúcar invertido surgirá coloração vermelho-cereja dentro de 5 a 10 minutos.
Reação de Lugol
- Transferir com o auxílio de uma pipeta 10 mL da amostra para um béquer de 50 mL e adicionar 10 mL de água destilada. Agitar e adicionar 1 mL de solução de lugol. Na presença de açúcar comercial a solução se corará de vermelho ou violeta (a intensidade da cor irá depender da qualidade e quantidade de dextrinas presentes no açúcar comercial).
Reação de Lund
- Pesar 2 g da amostra para um cilindro graduado de 50 mL com rolha esmerilhada, com o auxílio de 20 mL de água. Adicionar 5 mL de solução de ácido tânico a 0,5% e adicionar água até completar o volume de 40 mL.
- Agitar e deixar em repouso por 24 horas. Na presença de mel puro formar-se-á um depósito de 0,6 a 3,0 mL na presença de mel adulterado não haverá a formação de depósito ou este será desprezível.
Características microscópicas
- O exame microscópico deve ser realizado com o objetivo de distinguir os componentes figurados do mel comprovando assim, sua origem e pureza.
- Dissolver 2 g de mel em 25 mL de água destilada, filtrar em pequeno papel de filtro sem pregas. Montar em lâmina de vidro os resíduos insolúveis da filtração acumulados na parte central do papel com glicerina e observar ao microscópio.
* Ao microscópio não devem ser observados grãos de amido, nem fragmentos de órgãos de abelhas.
Avaliação
- Defina índice de refração.
- Que mede a reação de Lund?
- Que pode representar valores superiores a 3,0 mL neste experimento (reação de Lund)?
- Que é própolis?
- Pode-se usar etanol no lugar do éter etílico na reação de Fiehe? Justifique.
Referências bibliográficas
- Apostila sobre refratômetro de Abbé elaborada pela prof. Anair (QUI150) Costa, Aloísio F. Farmacognosia Vols. 1,2 e 3. 1978.
- Iorich, N. P. As Abelhas, Farmacêuticas com Asas. 2ª Ed. 1981
- Normas de Análises Bromatológicas – Divisão de Bromatologia – Laboratório Central de Saúde Pública. Vol. 2. Análise de mel e cera.
