Flavonoides e Antocianos
Disciplina de Farmacognosia I, UFPR
Os flavonoides são compostos naturais, derivados da benzo-γ-pirona, apresentando a estrutura química C6-C3-C6. Ocorrem no estado livre ou, mais comumente, como O-glicosídeos, embora exista um número considerável de C-glicosídeos. São conhecidos mais de 2000 flavonoides, sendo o maior grupo de compostos fenólicos naturais encontrados na natureza e, por isso, são usados como compostos marcadores quimiossistemáticos. Seu nome deriva do termo em latim flavus, que significa amarelo, embora a flavona pura seja incolor.
Terapeuticamente sua função não está ainda claramente esclarecida. O grupo é conhecido pelos seus efeitos anti-inflamatórios, antialérgicos e vasoprotetores (tratamento de tromboses). Rutina e hesperidina são importantes flavonoides empregados em tratamentos de fragilidade capilar.

As antocianidinas são flavonoides estruturalmente relacionados com a flavona. O nome é derivado do grego antho-, flor, e kyanus-, azul. São pigmentos encontrados na seiva, sendo que a cor do órgão é determinada pelo pH da seiva. O azul de determinadas flores e o vermelho da rosa podem ser devidos ao mesmo glicosídeo, em pH diferente.
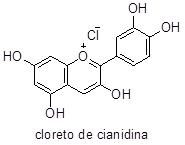
Os frutos do faveiro são ricos em rutina, sendo a droga de escolha para esta aula.
Aula Prática
Pesquisa de flavonoides
1. Extração
- Ferver, em banho-maria, 1 g de faveiro com 10 ml de solução de EtOH a 70% por 2 min;
- Filtrar por algodão.
2. Identificação genérica de flavonoides
Reação de Shinoda
- Colocar cerca de 2 ml do extrato alcoólico em um tubo de ensaio e adicionar mais ou menos seis fragmentos de Mg metálico;
- Adicionar 1 ml de HCl conc., observando se desenvolve coloração.
Reação com cloreto de alumínio
- Umedecer áreas diferentes de uma tira de papel de filtro com o extrato alcoólico obtido;
- Colocar sobre uma das regiões uma gota de solução de AlCl3 a 5% e comparar a fluorescência sob luz ultravioleta (ondas longas).
Pesquisa positiva → intensificação de fluorescência com mudança de cor para verde amarelado.
Reação de Taubouk
- Colocar cerca de 3 ml do extrato em uma cápsula de porcelana e levar ao banho-maria até secura;
- Esfriar e umedecer o resíduo com algumas gotas de acetona;
- Adicionar alguns cristais de ácido bórico e de ácido oxálico;
- Evaporar novamente em banho-maria até a secura, evitando aquecimento prolongado;
- Dissolver o resíduo em 3 ml de éter etílico e observar sob a luz ultravioleta.
Reação de Pew
- Colocar cerca de 3 ml do extrato em uma cápsula de porcelana e levar ao banho-maria até secura;
- Adicionar 3 ml de metanol e transferir o conteúdo da cápsula para um tubo de ensaio;
- Adicionar uma pequena porção de zinco metálico e adicionar mais ou menos três gotas de HCl conc.
3. Identificação de antocianidinas
O cloreto de cianidina, pigmento responsável pela coloração violeta do repolho-roxo e pela coloração vermelha das rosas, é um sal vermelho (pH ácido) e sua cor varia conforme o pH da solução.
Em solução fracamente básica (pH 8), toma a coloração violeta devido à formação da anidrobase, de estrutura quinoide. Em repouso, a solução torna-se incolor pela conversão da anidrobase para a pseudobase, onde perde-se a estrutura quinoide. Quando esta solução incolor passar para uma alcalinidade maior (pH 12), a cor passa a azul devido à formação do ânion da anidrobase. Se esta solução torna-se ácida (pH < 4), a cor passa a vermelho por causa da regeneração do cloreto de cianidina. Por outro lado, em repouso e solução alcalina, todos os compostos são convertidos em chalcona, de cor amarela.
- Colocar 15 g de repolho roxo, bem lavado e cortado em pedaços pequenos, em um béquer;
- Adicionar 100 ml de água;
- Extrair o pigmento por fervura durante 15 min;
- Filtrar para uma proveta e completar com água para 50 ml;
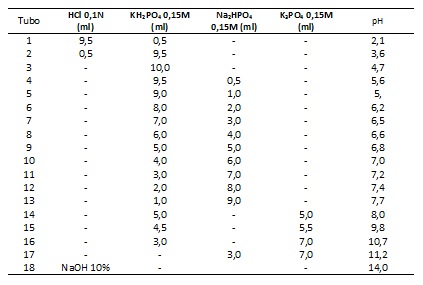
- Preparar 18 tubos de ensaio contendo soluções padrão conforme tabela abaixo;
- Colocar 2 ml da solução de repolho roxo em cada um dos tubos.
Preparação dos tubos contendo solução padrão:

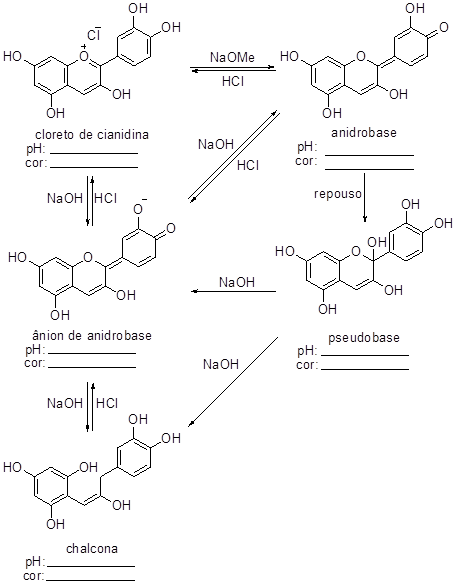
Apostila de Aula Prática de Farmacognosia UEL
Objetivo: Verificar a presença ou ausência de flavonoides na matéria-prima vegetal.
A)Preparo do extrato:
- Pesar 10g da droga vegetal seca.
- Adicionar 90 mL de álcool etílico a 75% ou hidroetanólico (1:1) e colocar no turbolizador por 15 mnutos.
- Filtrar com algodão. Completar o volume para 100 mL com o mesmo etanol.
B)Reação de Shinoda ou Reação de Cianidina
- Colocar 2 mL do extrato hidroetanóico (a 10% da droga vegetal) em uma cápsula de porcelana e evaporar em Banho Maria (45ºC) até secura (+/- 25-40min).
- Levar o resíduo da cápsula com 0,2 mL de clorofórmio para eliminação da clorofila, ainda no BM°.
- Redissolver o resíduo da cápsula com 1 mL de etanol 70% e tranferí-lo para um tubo de ensaio.
- Adicionar 200 mg de magnésio em pó ou raspas no tubo.
- Verter cuidadosamente, pelas paredes do tudo inclinado, cerca de 1 mL de HCl concentrado (CUIDADO! Pode ocorrer projeções, reação exotérmica).
- Observar a coração, esperando-se que se desenvolva uma coloração róseo-avermelhada.
Realizar esta técnica com padrão de quercetina dissolvido em q.s. de etanol.
REAÇÃO POSITIVA (COM COR) |
REAÇÃO NEGATIVA (SEM COR) |
| -Flavona – amarelo a vermelho -Flavonol – vermelho a vermelho-sangue -Dihidroflavonol – vermelho a vermelho-sangue -Flavanona – vermelho a violeta -Deriv. Antociânicos – vermelho para rosa |
-Chalconas -Auronas -Dihidrochalconas -Isoflavonas -Isoflavononas |
Deve aparecer coloração vermelha, quanto mais intensa a cor, maior a concentração dos flavonoides.
Drogas vegetais
Achyrocline satureioides (capítulos florais): marcela
Baccharis trimera (folhas): carqueja
Apostila de Aula Prática de Farmacognosia UFBA
Influência do pH nas Antocianidinas
Comportamento de pigmentos vegetais em relação ao pH das soluções.
A cor dos pigmentos vegetais está associada à sua estrutura química, e a sua coloração em meio ácido ou básico dependerá justamente das modificações ocorridas na molécula do pigmento, quando o mesmo é submetido a diferentes valores de pH.
Clorofilas, flavonoides e betalaínas são compostos sensíveis à mudanças de pH das soluções. Na clorofila a cor em meio ácido passa a verde oliva e em meio alcalino a verde brilhante.
Antocianinas tem cor vermelha intensa a valores de pH baixos. À medida que o pH aumenta a coloração passa a violeta.
Extrato da casca de uva
Extraído com água ou soluções alcoólicas da casca de uva vermelho escura, este extrato, dependendo da variedade, contém até 25 pigmentos diferentes. O corante é frequentemente denominado enocianina, e seu principal cromóforo presente na casca de uva é a mistura complexa de antocianinas: antocianidina (aglicona), açúcar e frequentemente ácidos. Na natureza, as antocianinas sempre ocorrem na forma heteroglicosídica, contendo uma ou mais moléculas de açúcar e da aglicona antocianidina. São solúveis em água e em mistura de água e álcool, porém insolúveis em óleos e gorduras.
Diferentes monossacarídeos (glicose, galactose, ramanose, arabinose), dissacarídeos e trissacarídeos também podem ser encontrados. Em alguns casos, o açúcar é acilado com os ácidos ferrúlico, cafeico e p-cumárico. A presença do grupo glicosídico na posição 3 confere maior estabilidade, sendo a forma diglicosídica mais estável ao aquecimento e à luz que a monoglicosídica, e a presença do grupo hidroxila na posição 3 aumenta a sensibilidade do composto à degradação.
O núcleo flavilium da antocianina é deficiente em elétrons e, portanto, altamente reativo. A sua reação geralmente envolve descoloração do pigmento, sendo, portanto, indesejável no processamento de frutas e vegetais.
Corantes comerciais derivados de uvas têm tido considerável sucesso em bebidas, mas todas as antocianinas convencionais apresentam algum tipo de limitação. Estabilidade é um problema, já que as antocianinas são degradadas na presença de metais, ácido ascórbico, açúcar, oxigênio, temperatura e enzimas.
A sensibilidade ao pH é fator limitante em várias situações, afetando a cor e a estabilidade química, descolorindo em valores de pH acima de 4,0. Em soluções ácidas, a antocianina é vermelha, mas com o aumento do pH a intensidade da cor diminui. Em solução alcalina, a cor azul é obtida, sendo porém instável. Para aplicação geral, o pH entre 1,0 e 3,5 confere maior estabilidade.
São utilizadas em bebidas ácidas, geleias, doces e cosméticos. A adição de ácido ascórbico para efeito de estabilização não é recomendada, e a presença de açúcares, especialmente a frutose, acelera o processo de escurecimento. Além do pH (principal responsável pela estabilidade das antocianinas), outros fatores contribuem para sua degradação.
- Sulfito - O dióxido de enxofre, utilizado na prevenção do escurecimento e crescimento microbiológico, promove a descoloração da antocianina, por sua adição na posição 2 ou 4. A cor, entretanto, pode ser regenerada por acidificação e aquecimento do produto para remover o dióxido de enxofre. Entretanto, alta concentração de sulfito (> 10 gramas/ kg) provoca destruição irreversível da antocianina para chalconas.
- Metais - As antocianinas, que possuem sistema 0-düdroxilado (anel B), complexam-se com metais, alterando sua coloração. Estes complexos são mais estáveis aos efeitos do pH e da luz que os compostos similares. Cianidina-3-glicosídica na presença de alumínio em pH 5,5 forma um complexo vermelho e, em presença de sais de ferro em pH acima de 5,5, um complexo azul. O aparecimento da coloração azulada em pêssegos enlatados é devido à complexação com zinco, sendo a perda da coloração rósea em pêras em razão do complexo cianidina-zinco.
Prática
Objetivo: Verificar o comportamento da coloração das antocianinas frente a mudanças de valores de pH.
Material de uso comum
- HCl concentrado
- HCl 5%
- NaOH 50%
- NaOH 5%
- NaCl
- FeCl3
- Sulfito de sódio a 10%
- Etanol
Material por grupo
- Tubos de ensaio
- Pipeta graduada 5 mL
- Gral com pistilo
Influência do pH
Triturar em gral cascas de uva roxa, utilizando uma mistura de 5 mL água e 5 mL de álcool para facilitar a extração do pigmento, filtrar e transferir 1 mL para 6 tubos de ensaio numerados de 1 a 6.
Adicione os reagentes conforme descrito abaixo e verifique as mudanças de coloração ocorrida durante a prática e anotando o pH para cada tubo de ensaio:
- No tubo n.º 01 adicione 1 mL de HCl conc.;
- No tubo n.º 02 adicione 1 mL de HCl 5%;
- No tubo n.º 03 não adicione nada;
- No tubo n.º 04 adicione 1 mL de NaCl;
- No tubo n.º 05 adicione 1 mL de NaOH 50%;
- No tubo n.º 06 adicione 1 mL de NaOH 5%.
Influência do Sulfito.
Tome 1 mL do extrato hidroalcoólico da uva e transfira para um tubo de ensaio. Adicione 1 mL de sulfito de sódio. Observar a coloração.
Influência de Metais.
Tome 1 mL do extrato hidroalcoólico da uva e transfira para um tubo de ensaio. Adicione 1 mL de cloreto férrico. Observar a coloração.
Avaliação
- Desenhe a estrutura da antocianidina
- Represente a estrutura das antocianidina nos diferentes pHs testados (neutro, ácido e básico).
- Cite mais três pigmentos de origem natural e suas aplicações na indústria farmacêutica e de alimentos.
Referências bibliográficas
- ARAÚJO, Júlio M. A. Química de Alimentos. Universidade Federal de Viçosa. 1995
- BOBBIO, Florinda O; Bobbio, Paulo A. Manual de Laboratório de Química de Alimentos. São Paulo. Livraria Varela. 1995.
- COSTA, Aloísio F. Farmacognosia, vol. 2, 1978.
- Farmacopéia Brasileira, 3ª edição.
